Een batterij werkt volgens het principe van een eenvoudige chemische reactie, die doorgaans plaatsvindt tussen drie elementen. De reactie tussen deze stoffen produceert een elektrische stroom. Dat is in het kort de essentie.
Drie belangrijke objecten:
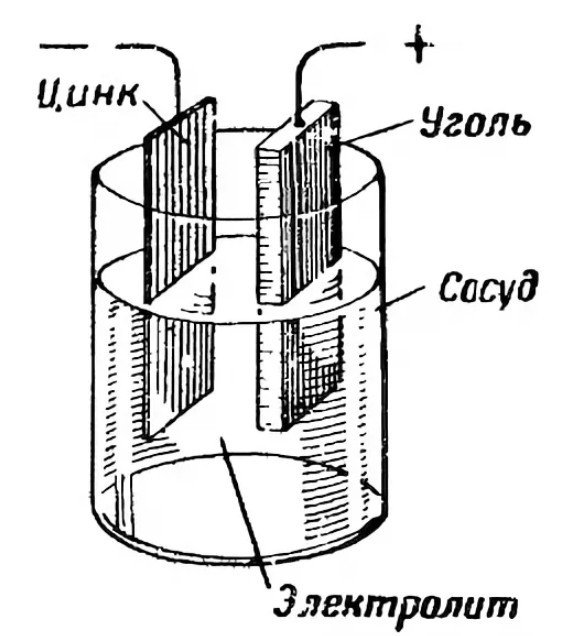
- Anode "+"
- Kathode "-"
- Elektrolyt
De anode, of positieve pool, dient als bron van elektronen. Deze is meestal gemaakt van zink. De twee elektroden staan met elkaar in verbinding via een elektrolyt. De elektrolyt is doorgaans een zout, ammoniumchloride of een alkali. Deze kan droog of vloeibaar zijn. Om de substantie te verdikken, voegen fabrikanten polymeerverbindingen toe. Sommige gebruiken zetmeel.
Hoe een batterij werkt
Stroom vloeit van de positieve pool naar de negatieve pool. Dit gebeurt wanneer een belasting op de accu is aangesloten. Het simpelweg verbinden van de positieve en negatieve pool met een draad veroorzaakt kortsluiting. Dit kan de accu snel leegtrekken en zelfs brand veroorzaken.
De kathode fungeert als reductiemiddel en neemt elektronen op van de anode. In de elektrolytomgeving bewegen ionen vrij en bevorderen ze een efficiënte stroomopwekking.
Wat gebeurt er chemisch gezien?
Bijvoorbeeld in glas. capaciteitLaten we een zwavelzuuroplossing gieten en er een zinkstaaf in leggen. Aan het oppervlak van de staaf bevinden zich positief geladen ionen. Negatieve ionen van de stof hopen zich op rond het zink in de oplossing. De oplossing oefent aantrekkingskrachten uit die de zinkionen gemakkelijk losmaken. Als gevolg hiervan krijgt de vloeistof een positieve lading en de zinkstaaf een negatieve lading. De natuurkunde leert ons dat potentiaalverschil gelijk is aan spanning. Dit is wat een elektrische stroom opwekt.
Als gevolg hiervan ontstaat er een elektrisch veld op het grensvlak wanneer de zure oplossing en het metaal met elkaar in contact komen. Op dat moment wordt chemische energie omgezet in elektrische energie. Zo werkt een batterij.
Na verloop van tijd raakt de batterij leeg. Het hangt er helemaal vanaf waar en hoe de stroombron wordt gebruikt. Als de batterij bijvoorbeeld een zaklamp van stroom voorziet, gaan twee 1,5-volt batterijen bij gemiddeld gebruik een maand mee. Maar als je diezelfde batterijen in een elektrische auto stopt, rijdt die maar een paar uur.
Hieruit kunnen we concluderen dat hoe groter de belasting, hoe sneller de batterij ontlaadt.
Lees ook: