De eerste galvanische cel ter wereld werd ontwikkeld door Luigi Galvani. Lees meer over de geschiedenis ervan. in dit artikelIn essentie is het een tijdelijke bron van elektrische stroom, opgewekt door een chemische reactie. De elektronenstroom wordt gegenereerd door de wisselwerking tussen twee verschillende metalen. Hierdoor wordt chemische energie omgezet in elektrische energie, die vervolgens in het dagelijks leven kan worden gebruikt.
Een concentratiegalvanische cel is een stroombron die bestaat uit twee identieke metalen elektroden die in een mengsel van zouten van dit metaal in verschillende concentraties zijn geplaatst.
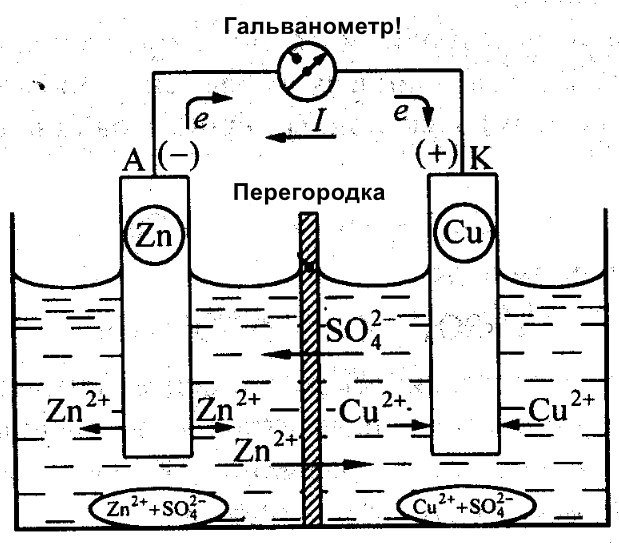
Naast Galvani werkte ook Daniel Jacobi aan de ontwikkeling van een efficiënte batterij. Hij paste zijn energiebron enigszins aan. Deze bestaat uit een koperen plaat in CuSO4 en een zinken plaat ondergedompeld in ZnSO4. Om directe interactie tussen de twee te voorkomen, is er een poreuze wand tussen geplaatst. Hieronder staat een schematische weergave van Daniel Jacobi's galvanische cel.
Zink en koper hebben een verschillende reactiviteit en daardoor verschilt hun lading. Hierdoor is de lading van de elektroden ook niet uniform. Dit maakt het mogelijk dat ze bewegen en een elektrische of galvanische stroom genereren. Deze stroom begint te vloeien wanneer een persoon of de uitvinder van een stroomopslagapparaat een belasting aansluit. Deze belasting kan een gloeilamp, een radio, een computermuis of een ander elektrisch apparaat zijn.
Schematisch diagram van een galvanische cel
Een schakelschema verwijst naar de samenstelling en structuur ervan. Het kan worden opgebouwd uit verschillende chemische elementen met behulp van hulpstoffen. Hieronder wordt de structuur van een galvanische cel kort beschreven. Lees er meer over in dit artikel.!
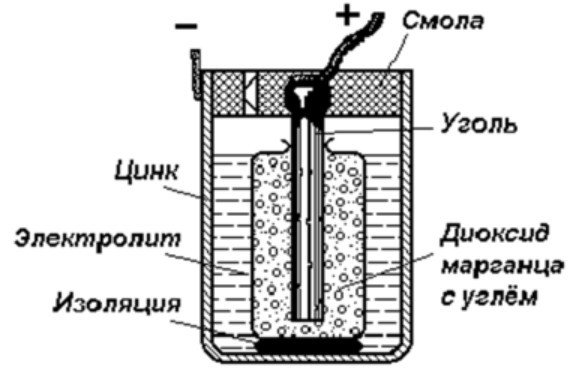
De structuur van een galvanische cel
Het eenvoudigste energieopslagapparaat bestaat uit:
- Staaf van steenkool.
- Twee verschillende metalen.
- Elektrolyt.
- Hars of plastic.
- Isolator.
Zoals in dit diagram te zien is, bestaat een galvanische cel uit een negatieve en een positieve elektrode. Deze kunnen gemaakt zijn van koper, zink of andere metalen. Ze worden koper-zinkcellen genoemd. Soms worden ze ook wel genoemd droge batterijen.
Aanduiding van een galvanische cel in een diagram Het is gemaakt in de vorm van twee verticale lijnen, dicht bij elkaar op een kleine afstand. Eén ervan is kleiner. Aan de uiteinden van elk van deze lijnen staan tekens die aangeven polariteitDe lange lijn is gemarkeerd als positief en de korte lijn als negatief. De spanning kan ernaast worden weergegeven. Dit betekent dat het circuit dat de batterij gebruikt, alleen op die spanning werkt.
Het werkingsprincipe van een galvanische cel
Een galvanische cel werkt door de beweging van elektronen van het ene metaalcontact naar het andere. Hierbij vindt een chemische transformatie plaats. Lees meer over de thermodynamica van een galvanische cel en de vorming van galvanische elektriciteit. Hier.
Antwoorden op veelgestelde vragen
| Galvanisch | Uitleg |
| Batterij | Een energiebron die werkt door processen die plaatsvinden in een beperkte, miniatuurruimte. Concreet wordt energie opgewekt door een chemische reactie. |
| Voltaïsche cel of voltaïsche stapel | Dit is een energie-element dat voor het eerst werd gecreëerd door een wetenschapper genaamd Volt. |
| Proces | De wisselwerking tussen chemische elementen die resulteert in de vorming van een elektrische stroom. |
| Afvoer | Dit is de voltooiing van een chemische reactie. Dat wil zeggen dat er geen interactie meer zal plaatsvinden tussen de stoffen. Galvanische ontlading is aanwezig in Warframe. Het is in feite een modificatie die schaars is. Het wordt gebruikt voor mêlee-wapens. PolariteitV2. |
| Galvanisch contact | Dit is het contact tussen de elektroden en de oplossing. |
| Effect | Het verschil dat ontstaat tussen twee contacten gemaakt van twee verschillende soorten metaal. De grootte van dit verschil hangt af van de temperatuur en de chemische samenstelling van de geleiders. In essentie is dit de eerste wet van Volta. |
| Verbinding/schakel/ketting | Het verbinden van twee of meer delen van een elektrisch circuit met een stroombron. |
| Galvanische lading | De batterij opladen met energie. |
Verzinken is een chemisch proces waarbij elektrische stroom wordt gebruikt. De reactie reduceert de hoeveelheid opgeloste metaalkationen zodanig dat ze uiteindelijk een uniforme laag vormen op een metalen elektrode. Hierdoor wordt het voorwerp duurzamer, verdwijnen kleine deukjes en krijgt het een aantrekkelijker uiterlijk.
Soorten galvanische cellen
Er bestaan verschillende soorten batterijen.
Tabel met galvanische cellen
| Type | Spanning | Belangrijkste voordelen |
| Lithium | 3 V | Groot capaciteithoge stroomsterkte. |
| Zoutbatterijen of koolstof-zink | 1,5 inch | De goedkoopste. |
| Nikkeloxyhydroxyl NiOOH | 1,6 volt | Hoge stroomsterkte. Hoog vermogen. |
| Alkalisch of alkalisch | 1,6 V | Hoge stroomsterkte. Goed volume. |
Dit onderwerp wordt uitgebreider behandeld in het artikel. soorten batterijen!
Doel van een galvanische cel
Het is ontworpen om elektrische apparatuur op te starten. Dit kan onder andere het volgende omvatten:
- Horloge.
- Afstandsbedieningen.
- Zaklampen.
- Medische apparatuur.
- Laptops.
- Speelgoed.
- Sleutelhangers.
- Telefoons.
- Laserpointers.
- Rekenmachines.
En soortgelijke dingen om ons heen.
Galvanische cel thuis
Je kunt zelf een eenvoudige stroombron maken. Hiervoor heb je de volgende materialen nodig:
- Plastic beker.
- Elektrolyt. Dit kan een zoutoplossing, soda of citroenzuur verdund in water zijn.
- Platen van twee verschillende metalen. Bijvoorbeeld aluminium en koper.
- Draden
Productieproces
Neem een plastic beker en giet de elektrolyt erin. Vul de beker niet tot de rand; het is het beste om er 1-2 centimeter onder te laten. Bevestig de draden aan de metalen plaatjes. Plaats vervolgens de koperen en aluminium plaatjes op de randen van de beker. Ze moeten parallel aan elkaar liggen. Zodra alles klaar is, kunt u de spanning meten met een voltmeter.
Sluit het apparaat aan en raak met de meetpennen de contactpunten van de stroombron aan. Houd ze daar totdat het display spanning aangeeft. Meestal is dit 0,5-0,7 volt. Deze waarden zijn afhankelijk van de elektrolyt, of preciezer gezegd, de stof die als elektrolyt wordt gebruikt.
Zo maak je een zelfgemaakte galvanische cel.